Bevezetés
Az anyag a világ látható építõköve. Megértésével, magyarázatával elsõként a filozófia foglalkozott. Az idealista (teremtéselvû) és a materialista (anyagelvû) felfogás az eredetet tekintve ellentétes magyarázattal szolgál. Az idealista filozófusok szerint az anyagot felsõbbrendû szellem teremtette, s a teremtéstõl létezik. A materialista felfogás szerint az anyag tudatunktól független, örökké létezõ objektív valóság. A természettudományok sem tudtak döntõ érveket hozni a fenti két alapvetõ felfogás mellett, vagy ellen.
A anyagi világot felépítõ építõkövek az atomok. Az atomok atommagból és elektronburokból épülnek fel. Az atommagot elektromosan töltéssel rendelkezõ (proton) illetve nem rendelkezõ (neutron) elemi részecskék alkotják. Az atommagban összpontosul az atom tömegének túlnyomó hányada, de a térfogatának csak töredékét teszi ki. Az atommagot alkotó részecskék közötti kölcsönhatás erõs. Az atommag körül elektronburok helyezkedik el, amelyben a protonnal azonos méretû, de ellenkezõ elõjelû elektromos töltéssel és jelentéktelen tömeggel rendelkezõ részecskék, az elektronok keringenek. A kiegyensúlyozottság érdekében az elektromosan semleges atomokban a protonokkal azonos számú elektronpályán keringenek elektronok.
Kémai jellemzõk
Az atomokban lévõ protonok száma (atomszám), illetve az ezeket kiegyensúlyozó elektronok száma alapvetõen megszabja az atomok kémiai viselkedését. A különbözõ atomszámú atomokat kémiai elemeknek nevezzük. Az oxigénben (atomszáma 8) például nyolc proton és nyolc neutron alkotta mag körül nyolc elektron kering. Az atomok "másodlagos nemi jellegeit", azaz vegyületalkotási hajlamát, oldhatóságát, más atomokhoz való kapcsolódásának módját alapvetõen az elektronpályák száma, helyzete és betöltöttsége határozza meg.
Az elektronpályákban csak bizonyos számú és geometriájú elektronpálya-konfiguráció lehetséges, illetve megengedett energetikailag. Ha ezek mind betöltöttek, akkor a következõ rendszámnál új elektronhéj kiépülése (periódus) kezdõdik.
A kémiai elemek az atommag és elektronhéj konfiguráció alapján periódusos táblázatba rendezhetõk. A táblázat oszlopai az elekronhéj pozicióinak elektronnal való betöltöttségét, a táblázat sorai az elektronhéjak számát jelzik. Az egy függõleges oszlopba tartozó elemek hasonló tulajdonságúak.
Az Univerzumban a H és a He a messze domináns elemek, a többi elem gyakorisága ezeknek csupán töredéke. A Földön a természetben 92 kémiai elem fordul elõ. A periódusos rendszer 92 feletti rendszámú elemei a természetben nem ismertek, csak mesterségesen állíthatók elõ. A 92 elem közül mindössze nyolc elem alkotja a Föld összetételének 99 %-át. Ezek mind az 56 atomsúlyig tartó sorozatba tartozó, ún. "könnyû" elemek, a periódusos rendszer 2-4 oszlopából. A mai fizikai ismereteink szerint az Univerzum elemeinek aránya, gyakorisági eloszlása az Õsrobbanást röviddel követõ idõszakban jött létre, s azóta gyakorlatilag változatlan.
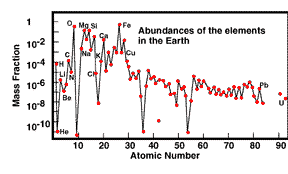
A feltételezések szerint a Föld átlagos összetételét legjobban a kondritos meteoritok közelítik meg. Az alábbi táblázat a kondritok átlagát, valamint a Föld becsült átlagos kémiai összetételét mutatja be.
A Föld és a kondritos meteoritok összetétele
|
Elem
|
Kondritok, súlyszázalék
|
Föld, súlyszázalék
|
|
O
|
33,24
|
29,5
|
|
Fe
|
27,24
|
34,6
|
|
Si
|
17,10
|
15,2
|
|
Mg
|
14,29
|
12,7
|
|
S
|
1,93
|
1,93
|
|
Ni
|
1,64
|
2,39
|
|
Ca
|
1,27
|
1,13
|
|
Al
|
1,22
|
1,09
|
|
Na
|
0,64
|
0,57
|
|
Cr
|
0,29
|
0,26
|
|
Mn
|
0,25
|
0,22
|
|
P
|
0,11
|
0,10
|
|
Co
|
0,09
|
0,13
|
|
K
|
0,08
|
0,07
|
|
Ti
|
0,06
|
0,05
|
Az általunk ismert és mintázható földkéreg kémiai elemeinek gyakorisága eltér a Föld átlagos összetételétõl. A kéregben az O, Si és az Al játszik döntõ szerepet, Ca, Mg, Na, K az összetételben jelentõsebb, a Fe, Mg, S kisebb arányú.
Geokémiai viselkedés szempontjából Goldschmidt 1922-ben az alábbi csoportosítást javasolta:
- sziderofil (Fe-hez társuló) elemek: pl. Co, Ni, Mo, Pt, Au
- kalkofil (S-hez kapcsolódó elemek: pl. Zn, Pb, Hg
- litofil (O-hez kapcsolódó) elemek: pl. Na, K, Rb, Mg, Ca, Al, Si
A fenti csoportok tulajdonságai közel azonosak, és a periódusos rendszerben is elkülönült csoportokat alkotnak. A csoportosítás csak hozzávetõleges, bizonyos elemek több csoportba is sorolhatók.
A tömegszám az atommagot alkotó protonok és neutronok együttes száma. A kémai elemek különféle izotópokból épülnek fel, az izotópokban a rendszámot (és ezért a kémiai karaktert) meghatározó proton mellé többlet neutron társulhat. A hidrogént például az általános H1 tömegszámú izotópján kívül H2 (deutérium) és H3(tricium) is alkotja, melyben egy, illetve két neutron kapcsolódik az atommagot alkotó egy protonhoz. Az összes izotóp tömegét arányával súlyozottan átlagolva kapjuk az elemre jellemzõ atomsúlyt (a H esetében 1,008).
Az atomok elõfordulhatnak önállóan, de leggyakrabban molekulákat alkotnak, azonos vagy eltérõ kémiai elemekhez kapcsolódva. A kémiai kötést, azaz a kapcsolódást, vegyülési hajlamot az atom elektronpálya konfigurációja, illetve az azon tartózkodó elektronok energiaszintje határozza meg.
Kémiai kötéstípusok közül a természetes ásványokban:
- kovalens kötés,
- ionos kötés,
illetve ezek keveréke fordul elõ a leggyakrabban. Az ionos kötés gyakorlatilag elektroncsere, a kovalens kötés elektron pálya átfedés útján jön létre. A kovalens kötés egyik változata a fémes kötés, amikor az elektronpálya átfedés nem csupán két rácspont, hanem az összes rácspont esetében jön létre. A kémiai kötés ionos, illetve kovalens természete az anyagok fizikai tulajdonságait is erõsen befolyásolja.
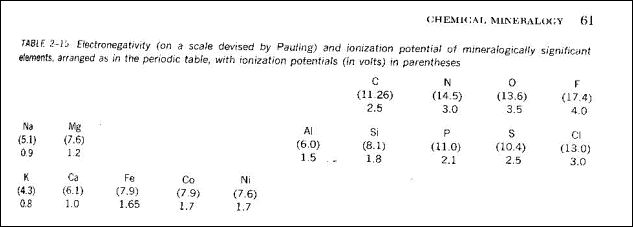
Az elektronegativitás az a tulajdonság, amely meghatározza azt, hogy a kémiai kötés kovalens vagy ionos természetû lesz-e. Az atomok elektronegativitását az ionizációs energia és az elektronaffinitás összegeként definiálhatjuk. Kis ionizációs energiájú/potenciálú elemek könnyen adnak le elektront (ionizálódnak), s válnak kationná. Nagy ionizációs potenciálú elemek elektronfelvételre hajlamosak, anionná alakulva. Az ionos kötésre hajlamos elemek a periódusos rendszer két szélén, az inkább kovalens kötést alkotó elemek a periódusos rendszer középsõ oszlopaiban helyezkednek el. Azok az elemek, amelyeknél az elektronpálya összes lehetséges pozició helye betöltött, sem elektronfelvételre, sem elektron leadásra nem hajlamosak, s így molekulákat , illetve vegyületeket sem alkotnak - a természetben ezeket nemesgázokként ismerjük.
Ionizációs energia az az energia, amely egy e elektronnak az atom külsõ elektronhéjából a végtelenbe való kilökéséhez szükséges. Elektronaffinitás az az energia, amely egy atom esetében egy elektron befogásához szükséges. Az alábbi táblázatban az ionizációs energia értékei (zárójelben), illetve az elektonegativitási érték (Pauling szerint) látható. A tapasztalat szerint azonos elektronegativitású elemek között kovalens, erõsen különbözõ elektronegativitású elemek között ionos kötés jön létre. Az ionizációs energia értéke a periódusos rendszer egy sorában balról jobbra nõ. A Földkéreg leggyakoribb épitõkövében, az SiO4 tetraéderben 50% ionos, 50 % kovalens a kötés.
Halmazállapotok
Az anyag a természetes körülmények között három halmazállapotban fordul elõ. Mindhárom halmazállapotú anyag részt vesz a földkéreg felépítésében. A földkéregben a szilárd halmazállapotú anyag a szilárd vázat, a folyékony és gáz halmazállapotú anyag oldott állapotú vegyületek szállító közegét alkotja. A halmazállapotok az anyagot alkotó molekulák energia tartalmától függnek. Szilárd halmazállapotban ez az energia viszonylag kicsi, az anyag atomjai méretük, töltésük és kötéstípusuk meghatározta rácsszerkezetben (kristályszerkezetben) rögzítve hõrezgést végeznek. A kristályos anyaggal energiát közölve a hõrezgés nõ mindaddig, amíg a rácsszerkezet felbomlik, molekula láncot alkotva folyékony halmazállapotú lesz. További energia felvétellel a molekula láncok is felbomlanak, egyedi molekulákká, gáz halmazállapotban. A folyamat nyomástól és hõmérséklettõl függ, és az egyes anyagokra jellemzõ folyamatgörbét követve megy végbe. A legjobban ismert halmazállapotok a Föld felszínéhez közeli viszonyokra vonatkoznak. A Föld belsejében lévõ igen nagy nyomás által deformált anyagok halmazállapota valószínûleg egyetlen, a felszínen ismert halmazállapotnak sem felel meg.
A földtan számos ága a szilárd természetes anyagokkal (ásványokkal) és ezek alkotta kõzetekkel, létrejöttükkel, fizikai viselkedésükkel foglalkozik (pl. ásvány-kõzettan, ércteleptan, litológia, sztratigráfia, stb). A földtani tudományok másik csoportja kifejezetten a szilárd közegben mozgó folyékony és gáz halmazállapotú fluidumokat vizsgálja (kõolajföldtan, vízföldtan, áramlástan, stb). Egy harmadik csoport a szilárd és fluid anyagok alkotta rendszer egészét vizsgálja (pl. szerkezetföldtan, geofizika, geokémia).
Egy másik csoportosítás szerint az anyagok szervesek (azaz szerves anyagokból származó szén alkotta vegyületek) vagy szervetlenek (nem szerves anyagokból származó, akár szénatomot is tartalmazó vegyületek). A földtanban a szerves és szervetlen anyagok egyformán jelentõs súlyt kapnak, bár a szerves anyagok a földtörténeti múlt kõzeteiben csak erõsen módosult formában nyomozhatók (pl. kõszén, kõolaj, borostyán, stb).
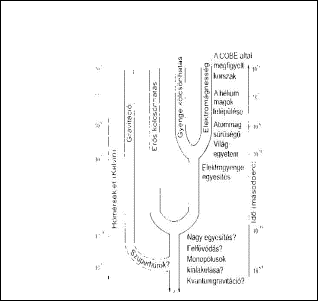
Erõ - az anyag mozgatója
A természetben ma négyféle erõt, kölcsönhatást ismerünk.
Gravitáció
A klasszikus fizika szerint az anyag illetve részecskéi a térben mozognak, s mozgásuk iránya, illetve sebessége akkor változik, ha erõ hat rájuk. Az erõ egyik formája egy távolra ható gyenge kölcsönhatás, a gravitáció. A gravitáció a tömegektõl függõ nagyságú vonzás, amely tömegek szorzatával egyenesen, távolságuk négyzetével fordítottan arányos.
A gravitáció hatása a domináns bármiféle tömeg mozgásában természetes közegekben - így a gravitáció jelenségét vizsgáljuk, ha a folyóvizek hatását, a tengeri áramlatokat, a szél szállítóképességét, illetve a magma feláramlását vizsgáljuk.
Elektromos kölcsönhatások
Az erõ másik formája egy rövid távolságra ható erõs kölcsönhatás, amelynek során atomi méretekben erõk mûködnek, gyakorlatilag kétféle dolog között. Ha ezek a dolgok egyformák, az erõ taszítás, ha különbözõek, vonzás lép fel közöttük. Ezt a kölcsönhatást fenntartó jelenséget töltésnek nevezzük, a kétféle típust a megállapodás szerint pozitív és negatív jellel jelöltük. A töltéssel nem rendelkezõ anyag kiegyensúlyozott, a negatív és pozitív töltések hatása egymást kiegyenlíti.
Az anyagot négy fajta erõ - kölcsönhatás - mozgatja: a gravitáció, az erõs atommag kölcsönhatás a gyenge atommag kölcsönhatás és az elektromágnesség. Az elektromos kölcsönhatás több nagyságrenddel nagyobb erõsségû, mint a gravitáció, de mivel az atomok pozitív és negatív töltésekbõl épülnek fel, így a töltések szempontjából kiegyensúlyozottak, erõhatás nem észlelhetõ. Egészen kevés töltés többlet vagy hiány észrevehetõ elektromos hatást hoz létre. A töltések körül elektromos tér alakul ki, ebben a térben a töltésekre erõk hatnak, melyek mozgásba hozzák õket. Bár a töltések létrehozta erõ a távolság négyzetével csökken, a töltés mozgatásával a hatás lényegesen távolabbra is terjed - hullámjelenségek lépnek fel, elektromágneses tér keletkezik. Az elektromágneses hullámok frekvenciától függõen számos formában jelentkezhetnek:
| - 105 - 106 |
rádióhullámok |
| - 1010 |
radar |
| - 1014 - 1015 |
látható fény |
| - 1018 |
röntgen |
| - 1021 |
atommagok gammasugárzása |
| - 1027 |
kozmikus sugárzás |
Az elektromos kölcsönhatások eredménye minden kémiai reakcióként ismert folyamat, kõzetképzõdés és oldódás, mállás, oxidáció, hidratáció. Hasonló kölcsönhatásokra épül a Föld elektromos erõterének vizsgálata s ennek alkalmazása a földtani kutatások során.
Magerõk
Az 1920-as évektõl kezdõdõen, az atommag részletes megismerésével jutott el a fizika két másik kölcsönhatás megismeréséig. Az egyik az atommagot összetartó erõs kölcsönhatás, a magerõ, amely az elõzõekhez képest nagyságrendekkel nagyobb energiát tárol. Az elõzõ, elektromos jellegû kölcsönhatás során felszabaduló kémiai energia és a magerõk felszabadítása között akkora a különbség, mint egy hagyományos bomba és egy atombomba felrobbanása során felszabaduló energia között. Ez az erõ az, amely a protont és a neutront az atommagban összetartja.
Béta-bomlás
Részlegesen ismert kölcsönhatás, melynek során a neutron lassan protonra elektronra és neutrinóra bomlik.
A négyféle kölcsönhatás nagyságrendi arányai:
| Magerõk |
1 |
| Elektromos kölcsönhatás |
10-2 |
| Béta-bomlás |
10-5 |
| Gravitáció |
10-40 |
Mai feltételezésünk szerint ezek az erõk az Õsrobbanást követõen 15 GeV energiaszinten, 1028 K hõmérsékleten, 10-35 sec idõben váltak szét egymástól.
Az energiának, az erõk kifejezõdésének sok különbözõ megjelenési formája van: - gravitációs (helyzeti), - kinetikus (mozgási), - rugalmas, - hõ, - kémiai, - radioaktív, - mag, - tömegenergia. Az energiára az energiamegmaradás törvénye érvényes. Ez azt állítja, hogy van egy bizonyos, energiának nevezett mennyiség, amely a természetben végbemenõ változások során, idõtõl függetlenül változatlan marad. Ehhez kapcsolódik néhány más megmaradási törvény: az impulzusmegmaradás, töltésmegmaradás, és még három, a szubatomi részecskék világát leíró megmaradási törvény.
A rendelkezésre álló energiát, illetve az energiák keltette folyamatok lezajlásának menetét a termodinamikai törvények írják le. Ezek lényege, hogy az energia megmarad, de a felhasználható energia ennek csak egy része. |

